Goiânia aplicou 1,7 mil doses de vacina suspensa
Anvisa determinou a interdição de lotes da vacina CoronaVac
Por: Redação
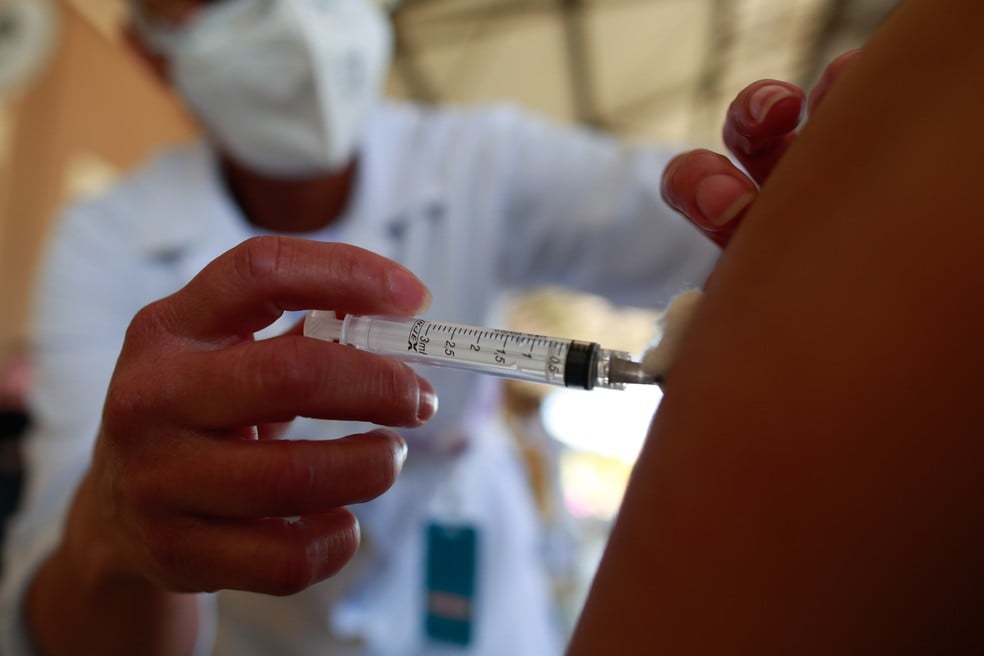
A Secretaria Municipal de Saúde (SMS) de Goiânia informou ontem (06/09) que recebeu um lote de vacinas do laboratório do qual a Agência Nacional de Vigilância Sanitária (Anvisa) emitiu medida cautelar. Segundo a pasta, constavam no lote 2.200 doses, das quais aproximadamente 1.700 foram aplicadas na Capital. As doses restantes serão devolvidas à Secretaria de Saúde de Goiás (SES-GO).
Questionada sobre quando as pessoas teriam sido vacinadas com as doses do respectivo lote e como as pessoas que receberam a vacina serão localizadas, a pasta informou que aguarda publicação de nota conjunta do Ministério da Saúde (MS), Anvisa e Instituto Nacional de Controle e Qualidade em Saúde (INCQS) sobre a eficácia do imunizante em questão e sobre como proceder em relação às pessoas vacinadas.
Entenda
No último sábado (04/09), a Anvisa determinou a interdição cautelar de lotes da vacina CoronaVac, proibindo a distribuição e o uso dos lotes envasados na planta não aprovada na Autorização de Uso Emergencial (AUE). De acordo com a Anvisa, em reunião iniciada às 16h do último dia 03 e, posteriormente, por meio de ofício encaminhado às 20h44 do mesmo dia, a Agência foi comunicada pelo Instituto Butantan que o parceiro Sinovac, fabricante da vacina CoronaVac, enviou para o Brasil 25 lotes na apresentação frasco-ampola (monodose e duas doses), totalizando 12.113.934 doses. A unidade fabril responsável pelo envase não foi inspecionada e não foi aprovada pela Anvisa na Autorização de Uso Emergencial da referida vacina. À ocasião, o Instituto informou ainda que outros 17 lotes, totalizando 9 milhões de doses, também envasados no local não inspecionado pela Agência, estão em tramitação de envio e liberação ao Brasil.
Decisão
Diante disso, a Anvisa entende que, nesses termos, a vacina envasada em local não aprovado na AUE configura-se em produto não regularizado junto à Anvisa. Com isso, tornou-se essencial a atuação da Agência com o intuito de mitigar um possível risco sanitário. Tal ação se deu por meio da publicação de duas Resoluções (RE), no sábado (04), em Edição Extra do Diário Oficial da União (D.O.U.), sendo: Resolução (RE) para a interdição cautelar proibindo a distribuição e o uso dos lotes envasados na planta não aprovada na AUE; e a Resolução (RE) determinando a proibição de distribuição dos lotes ainda não distribuídos.
Alerta
Sobre o processo de validação das vacinas, o médico sanitarista e professor de Saúde Pública do Centro Universitário São Camilo, Sérgio Zanetta, explica que as vacinas que estão sendo aplicadas no Brasil contam com uso emergencial aprovado, e assim, a cada lote que chega, a Anvisa concede um prazo mínimo de validade de 6 meses. “É provável que essas vacinas tenham validade maior do que o prazo estipulado. Elas são recebidas diretamente da fábrica com um prazo de validade, em outros casos, receberam novos frascos ou rótulos. Por exemplo: a Fiocruz colou uma etiqueta, porque não se pode administrar medicamentos sem que esteja com informações em português, e o Ministério da Saúde distribuiu as doses”, afirmou o especialista.
Segundo o infectologista, todos os controles de validade e das condições dos medicamentos e das vacinas fazem parte dos procedimentos padrão do Sistema Único de Saúde (SUS). “Se tem uma vacina ou qualquer medicamento com problema de validade, quem aplica a vacina deve atestar, recolher e guardá-las e depois a Vigilância Sanitária decide sobre a destinação. Mas, em todo caso, o profissional não deve realizar a aplicação. Esta é uma questão técnica importante”, destacou o médico ao O Hoje. (Maiara Dal Bosco, especial para O Hoje)
